平衡的肠道维甲酸(retinoic acid)浓度对于维持肠道的免疫平衡至关重要。新发表在Cell Host & Microbe的文章Gut commensals expand vitamin A metabolic capacity of the mammalian host,揭示了宿主-微生物群代谢的相互作用,并在维生素A代谢的背景下,在分子水平上将饮食、微生物群和宿主功能精妙地联系起来。下面内容是结合以前的研究中讨论了这项工作,这些研究强调了在维生素的代谢和功能中宿主-微生物相互作用和合作的重要性。
01
人类肠道微生物是决定宿主生理和健康的一个重要因素。我们肠道中的微生物有助于营养物质的吸收,并且已知参与了维生素的代谢。维生素是在细胞代谢中具有重要作用的微量营养素,但宿主不能内源性地或足量地合成这些物质。
据报道,肠道微生物的几个成员,如乳酸菌(LAB)和双歧杆菌,可以从头合成B族和K族维生素,估计为宿主提供30%的每日摄入量(LeBlanc et al,2013)(图1A)。细菌产生维生素的能力通常是物种或甚至菌株特定的,因此取决于肠道微生物的组成和宿主的饮食。基于细菌基因组注释的代谢模型表明,不同的肠道群落成员之间的合作对于合成某些维生素是必要的(Magnu ́ sdo ́ tir,2015)。有趣的是,维生素也被证明可以调节肠道微生物群的组成(Steinert et al,2020)。例如,最近的一项研究表明,维生素D的活性代谢物,1,25-二羟基胆钙化醇,即维生素D受体(VDR)的配体,会影响来自美国不同地区的老年男性的肠道微生物群的α和β多样性(Thomas et al,2020)(图1A)。总的来说,维生素似乎是代谢微生物群与宿主相互作用的一个重要媒介,但我们现在才发现其背后的分子机制。
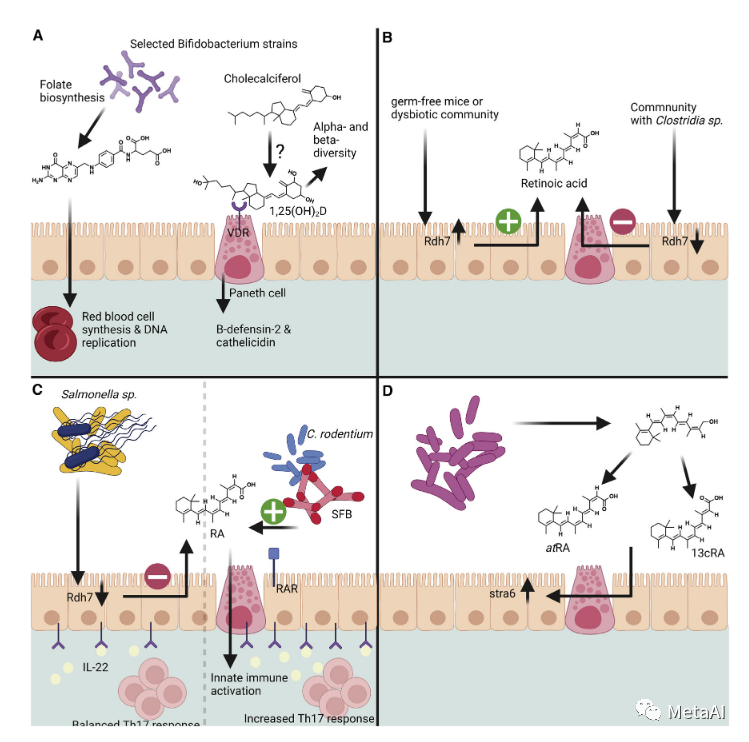
图1。维生素代谢中肠道内微生物群-宿主的相互作用(A)维生素B组和维生素D宿主-微生物群相互作用的例子。叶酸可以由某些双歧杆菌的菌株从头合成。宿主细胞中的叶酸对于红细胞的合成以及DNA的复制、甲基化和修复是必不可少的。(B)肠道微生物群和RA对宿主Rdh7酶表达的影响。C)RA介导的免疫反应在预防病原体定植中的作用和肠道微生物群的重要性。(D) 肠道微生物群的不同成员可以将饮食中的维生素A生物转化为其活性代谢物,atRA和13cRA。这些代谢物可以诱导stra6的表达,其功能是作为一个视黄醇转运器,并与下游的RA信号传导途径相联系。Rdh7,视黄醇脱氢酶7;SFB,分段丝状菌;RAR,视黄酸受体;RA,视黄酸;atRA,全反式视黄酸;13cRA,13-顺式视黄酸。
02
新发表的这项研究表明,肠道细菌能够将饮食中的维生素A生物转化为其活性代谢物视黄酸(RA),然后在宿主组织中引发依赖维生素A的反应(Bonakdar et al,2022)。视黄酸在维持免疫平衡和防止病原体入侵方面有几个重要功能。在这项研究之前,人们认为肠道上皮细胞(EIC)和树突状细胞中的代谢酶可以将维生素A转化为其活性形式。一个尚未完全定性的调节过程将肠道吸收的膳食维生素A分流到生物转化或分流到肝脏储存(Iyer & Vaishnava, 2019)。下面结合以前的研究中讨论这项工作。
一份关于饮食诱导的小鼠维生素A缺乏症(VAD)的早期报告表明,VAD抑制了Th17的分化,导致回肠组织中IL-17、IL-22和IL-23的低表达水平(Cha et al ,2010)。值得关注的是,VAD饮食导致MUC2表达的增加和腺泡细胞增生,并减少了肠道微生物群中的分段丝状细菌。此外,Grizotte-Lake et al表明,肠道微生物群可以影响EICs中RA合成酶的表达水平,并以成分依赖的方式影响肝脏中维生素A的储存(Grizotte-Lake et al,2018)。比较无菌(Germ-free GF)和用孢子生成菌定植的GF小鼠之间视黄醇脱氢酶7(Rdh7)的表达,同一作者发现梭菌类的孢子生成菌抑制Rdh7的表达,导致小肠组织中RA水平下降(图1B)。此外,万古霉素诱导的肠道微生物失调也导致了Rdh7的更高表达和RA水平的增加。基于这些发现,有人认为RA将微生物群组成与肠道组织中的维生素A代谢和RA的下游功能(如免疫调节)联系起来。
事实上,在不同的感染背景下,已经描述了维生素A影响宿主免疫力的几种机制,如沙门氏菌的肠道感染和肠道细菌感染(回顾:Iyer & Vaishnava, 2019)。一般来说,RA在肠道组织中的浓度对免疫反应的确定起着作用。RA依赖的免疫反应可以是有益的,也可以是致病的,这取决于感染的类型和肠道环境。例如,VAD与非伤寒沙门氏菌血清感染的高易感性有关,而肠道RA浓度过高则有助于同一病原体在肠道内定植,因为其对IL22驱动的免疫反应的抵抗力使其过度繁殖,而肠道共生菌种被取代(图1C)。在这种情况下,梭菌类的细菌物种,可以抑制IECs的RA合成,防止沙门氏菌感染(GrizotteLake et al,2018)。基于这一数据,RA在肠道中的浓度被认为是维持肠道免疫系统调节和炎症反应之间平衡的一个重要因素。通过不同的机制,维生素A的代谢也被认为在防御枸橼酸杆菌感染中发挥了作用(Woo et al,2021)。EICs中的视黄酸受体(RAR)可以感知RA,并通过与RA的结合被激活。激活后,RAR会诱导几种先天免疫反应。Woo et al还描述了分节肢丝状菌(SFB)可以帮助EICs抵御C.rodentium的感染,通过增加RA/维生素A的浓度,促进先天免疫反应并驱动Th17细胞分化(图1C)(Woo et al,2021)。
在Bonakdar et al的这项新研究中,又提出了另一种途径,即肠道微生物群影响肠道中的RA浓度。研究人员发现,除了以前报道的微生物对宿主的维生素A代谢的调节外,肠道细菌本身也能将维生素A生物转化为活性代谢物。作者利用小鼠肠道微生物群落的体外培养来实验评估肠道微生物将维生素A转化为其活性代谢物的能力。在这些培养物中加入维甲酸酯或视黄醇后,作者还可以观察到群落组成的变化,乳酸菌属的细菌有所增加。此外,作者从肠道微生物群落中分离出一株肠道乳杆菌,它能将维生素A生物转化为全反式维甲酸(atRA)。给经万古霉素处理的小鼠补充这种菌株,可诱发VAD,恢复这些动物的atRA水平。此外,作者还表明,给经万古霉素处理的小鼠补充肠道菌株能诱导小肠组织中Stra6的表达。Stra6是一个已知的RA诱导基因,它对宿主细胞吸收和输出视黄醇至关重要,并被认为是一个信号枢纽,将视黄醇途径与决定细胞命运的其他途径结合起来。
这项研究和Woo et al之前的报告显示,肠道微生物可以成为RA的直接来源,如某些物种可以为宿主提供B族维生素(LeBlanc et al,2013;Woo et al,2021)。此外,共生的肠道群落可以通过STRA6(一种视黄素转运器和下游信号通路激活器)与宿主协调调节维生素A和RA的浓度(Bonakdar et al,2022)。总的来说,这些最近的结果有助于提高对宿主和肠道微生物如何沟通以维持维生素A平衡的理解。
03
微生物群与宿主密切协调,调节维生素A的浓度、代谢和活性,是说明宿主与其肠道微生物群之间代谢互动的一个代表性例子。所讨论的工作表明,通过经典的微生物学技术、使用质谱法进行有针对性的特定代谢物测量以及使用非生物动物,可以发现这种代谢微生物群-宿主互动的分子机制。微生物群可以成为RA的来源,类似于不同的B族维生素,这一发现令人感兴趣,并强调了肠道微生物群为其宿主提供微营养素的重要性。关于宿主和微生物群之间在维生素A代谢方面的交叉对话,仍然存在一些问题。例如,维生素A及其代谢物如何影响肠道微生物群落的组成和代谢活动仍有待研究。就维生素D而言,最近的一项研究报告了维生素D对肠道微生物群的α和β多样性的影响。然而,据我们所知,目前仍不清楚微生物群是否可以成为维生素D的活性代谢物1,25-二羟基胆化醇的来源(图1A)。对于其他维生素和不同的分子类别,如激素、胆汁酸和其他饮食化合物,可能也有类似的代谢互动。进一步了解代谢性微生物群宿主相互作用的分子机制,对于提高我们对微生物群在人类健康中的作用的机理理解,以及最终开发利用微生物群功能的治疗策略,在未来是至关重要的。
文章来源:https://doi.org/10.1016/j.chom.2022.07.010
参考文献:
Cha H.-R et al. Downregulation of Th17 Cells in the Small Intestine by Disruption of Gut Flora in the Absence of Retinoic Acid. J. Immunol. 2010; 184: 6799-6806 https://doi.org/10.4049/jimmunol.0902944Grizotte-Lake M et al. Commensals Suppress Intestinal Epithelial Cell Retinoic Acid Synthesis to Regulate Interleukin-22 Activity and Prevent Microbial Dysbiosis. Immunity. 2018; 49: 1103-1115.e6 https://doi.org/10.1016/j.immuni.2018.11.018Hill M.J. Intestinal flora and endogenous vitamin synthesis. Eur. J. Cancer Prev. 1997; 6: S43Iyer N et al. Vitamin A at the interface of host–commensal–pathogen interactions. PLoS Pathog. 2019; 15e1007750 https://doi.org/10.1371/journal.ppat.1007750LeBlanc J.G et al. Bacteria as vitamin suppliers to their host: A gut microbiota perspective. Curr. Opin. Biotechnol. 2013; 24: 160-168 https://doi.org/10.1016/j.copbio.2012.08.005Magnúsdóttir S et al. Systematic genome assessment of B-vitamin biosynthesis suggests co-operation among gut microbes. Front. Genet. 2015; 6 https://www.frontiersin.org/article/10.3389/fgene.2015.00148
Bonakdar M et al. Gut commensals expand vitamin A metabolic capacity of the mammalian host. Cell Host Microbe. 2022; 30: 1084-1092.e5 https://doi.org/10.1016/j.chom.2022.06.011Steinert R.E et al. Vitamins for the Gut Microbiome. Trends Mol. Med. 2020; 26: 137-140 https://doi.org/10.1016/j.molmed.2019.11.005Thomas R.L. et al. Vitamin D metabolites and the gut microbiome in older men. Nat. Commun. 2020; 11: 5997 https://doi.org/10.1038/s41467-020-19793-8Woo V. et al. Commensal segmented filamentous bacteria-derived retinoic acid primes host defense to intestinal infection. Cell Host Microbe. 2021; 29: 1744-1756.e5 https://doi.org/10.1016/j.chom.2021.09.010 |