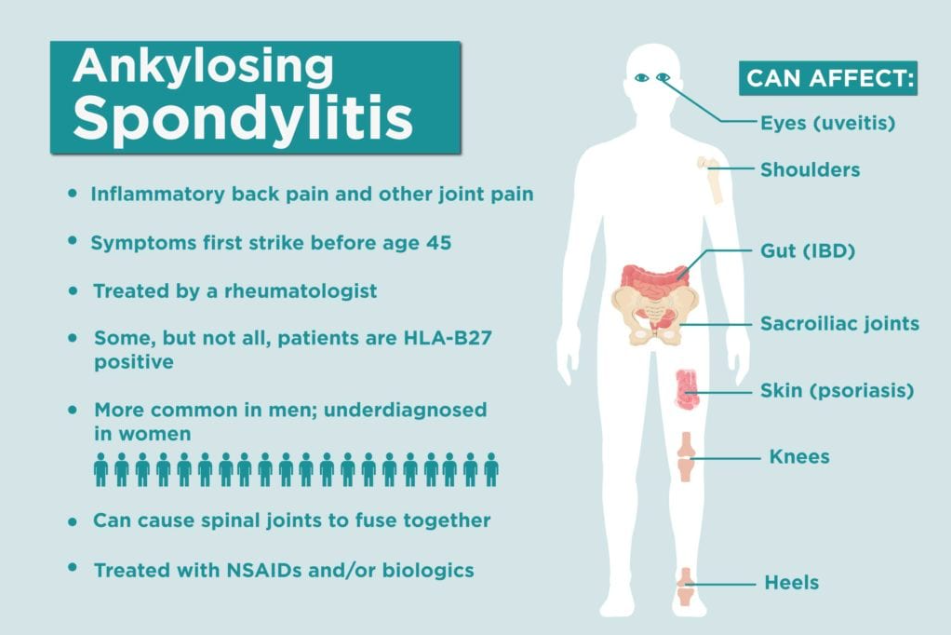 
强直性脊柱炎(Ankylosing spondylitis,AS)是一种常见的慢性免疫介导性炎症疾病,发病机制复杂,该疾病被认为是遗传和环境相结合的结果,然而具体发病因素目前尚未完全阐明。
01
人类白细胞抗原B27 (HLA-B27)是AS的主要危险因素。HLA-B27是一种已知的遗传标记,存在于90%–95%的 AS患者中。另外,也有学者认为环境因素,包括微生物组、炎症、感染和药物等也可能在AS发病机制中发挥重要作用[1]。
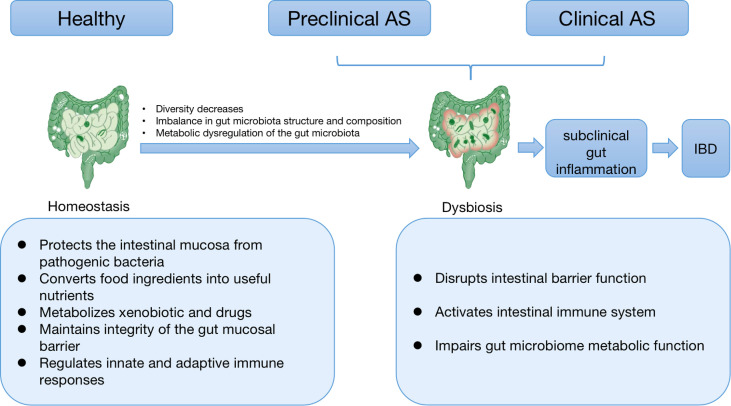
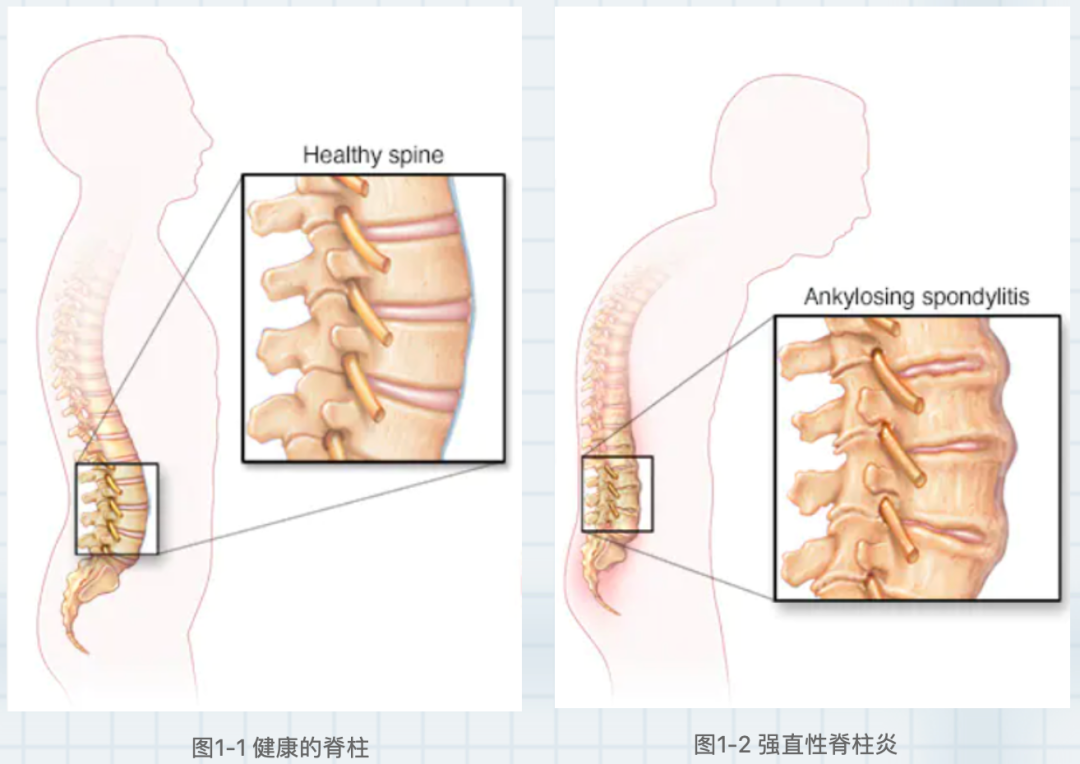
图2 肠道生态失调、肠道炎症和 AS 之间的关系
2015年,一项研究使用16S微生物测序对9名AS患者和健康志愿者的末端回肠活检中微生物组进行对比。研究者发现AS患者中的几个细菌科,包括毛螺菌科、瘤胃球菌科、拟杆菌科、理肯菌科、卟啉单胞菌科丰度显著增加,而韦荣球菌科、普氏菌科的丰度下降[2]。
据报道,一些细菌在 AS 发病机制中起着重要作用,例如肺炎克雷伯菌和普通拟杆菌[3]。此外,一项对59名AS患者粪便的产气克雷伯菌的研究表明,AS患者粪便中存在产气克雷伯菌且与HLA-B27阳性患者的某些关节性炎症显著相关,虽然克雷伯氏菌属与AS的作用机制尚未阐明,但是这提示说AS与肠道菌群存在联系。
值得注意的是,Th17免疫细胞在免疫介导型疾病中的重要性在小鼠模型中得到了证实,因此Th17免疫细胞被认为在AS的发病机制中起着重要作用[4]。而肠道微生态发生变化,如肠道菌群失衡会改变肠道屏障功能或影响肠道菌群及其代谢物从而直接或间接改变Th17免疫细胞的免疫反应。
02
由此,有学者提出了“肠-关节免疫轴”的相关概念,“肠-X轴”的互作可做为药物开发的新靶点,肠道菌群可通过涉及肠神经、免疫系统、肠内分泌信号等途径,调节机体组织、器官功能及行为,进而有益于宿主健康。

图3
哺乳动物的胃肠道定植着数万亿的微生物,这其中包括细菌、真菌、寄生虫和病毒。这些体内的微生物群体大多聚集在肠道远端,也被称为肠道微生态。在健康个体中,这种肠道菌群与免疫系统之间的双向作用处于良好的平衡状态,但是如果这种稳态被打破,对应的异常就称为肠道菌群失调,这可能引起消化系统和非消化系统疾病,例如炎症性肠病和代谢性疾病。
图4 肠道菌群失调
大约60%的AS患者患有肠道炎症,这表明这两种疾病可能具有潜在的联系或具有共同的发病机制,如肠道菌群失调。
尽管肠道微生物在AS疾病发展中的作用的相关证据越来越多,但其生物学机制仍不清楚,有几种机制被提出以解释微生物组在AS疾病中作用,例如肠道通透性的改变、免疫反应的刺激和分子拟态。
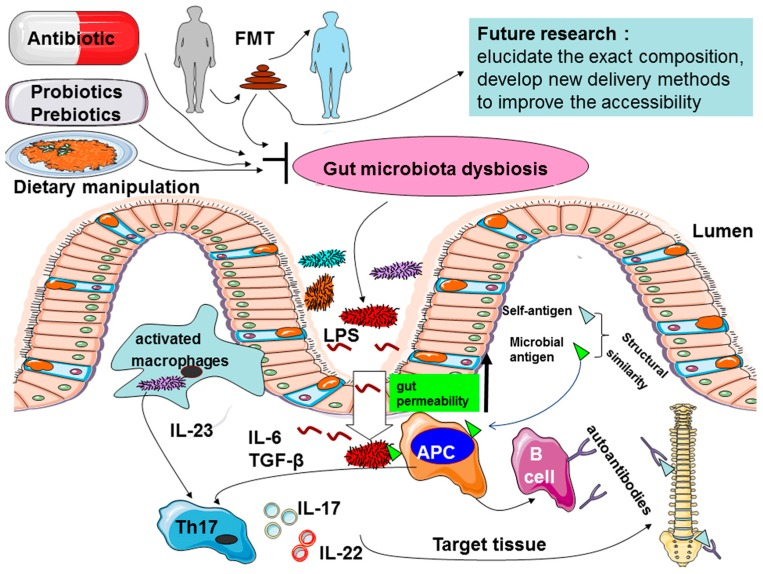
图5 肠道菌群失调导致AS炎症的可能机制以及FMT治疗
03
肠上皮细胞是抵御共生微生物和病原微生物的重要物理和生化屏障,可保护宿主与微生物的相互作用并维持组织稳态。当其能力出现问题或者遭到破坏时,会导致肠道通透性增加,这被称为肠漏症。肠道菌群失调会导致粘膜屏障受损,增加共生菌群的渗透,这在疾病的发生和发展过程中十分重要。
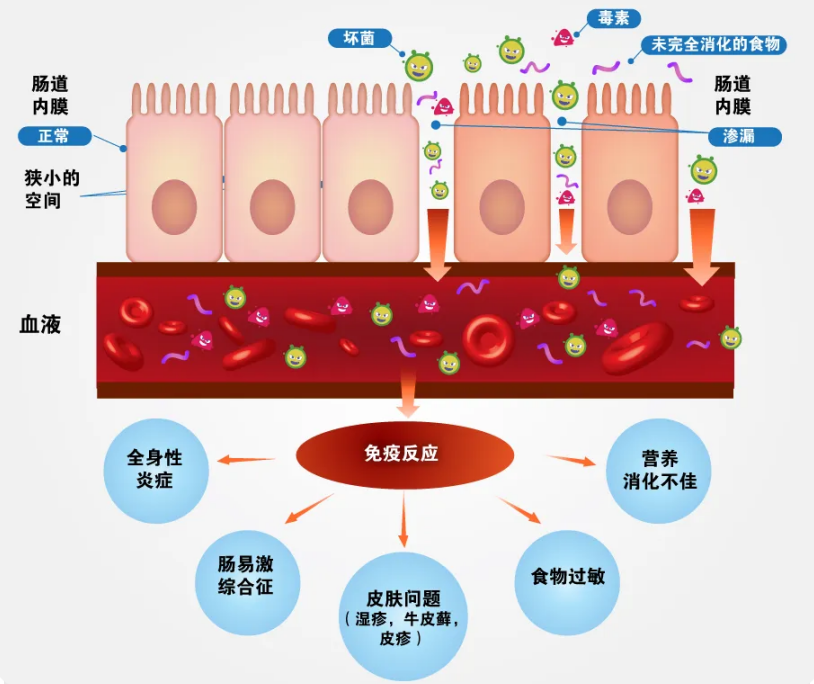
图6 肠漏综合征
研究发现,AS患者的肠道通透性增加,脂多糖(LPS)是内毒素的有毒成分,进入血液后会引起严重的全身炎症反应。一些初步证据表明,AS 中可能存在高血清水平的 LPS 和脂肪酸结合蛋白,这与肠道通透性显着相关。
许多免疫细胞(例如,Th17、Treg、ILC3、MAIT、γδ T、NKT、LTi 样细胞、DC、巨噬细胞等)存在于肠粘膜中。生态失调会触发这些细胞增加促炎细胞因子(如 IL-17、IL-23、TNF-α、IFN-γ、IL-7、IL-22 等)并减少抗炎细胞因子(如IL-10)。这会激活 IL-23/IL-17 通路并增加 Th17/Treg 比率,最终引发或加剧肠道和关节的炎症。
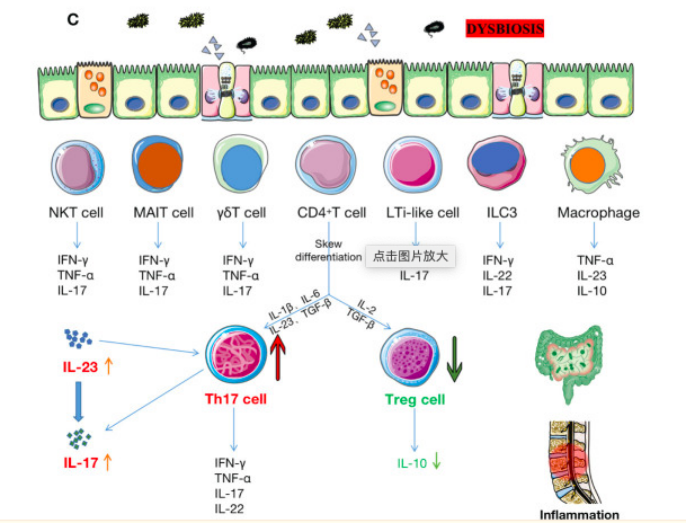
图7 免疫细胞对肠道及关节炎症的影响
04
由于肠道微生物群的变化是AS发病机制的重要因素,因此它们可以被认为是AS的新治疗靶点。抗生素是控制肠道内含物的一种有效治疗手段,但是长期使用抗生素会显著降低肠道微生物群的生物多样性,同时也可能形成抗生素耐药性。
对于微生态疗法,目前国际上认为最科学的方式为肠道菌群移植(FMT)。肠道菌群移植(FMT)是将特定的健康人粪便中的功能肠道菌群移植到患者肠道内,重塑失衡的肠道菌群,实现肠道及肠道外疾病的治疗。
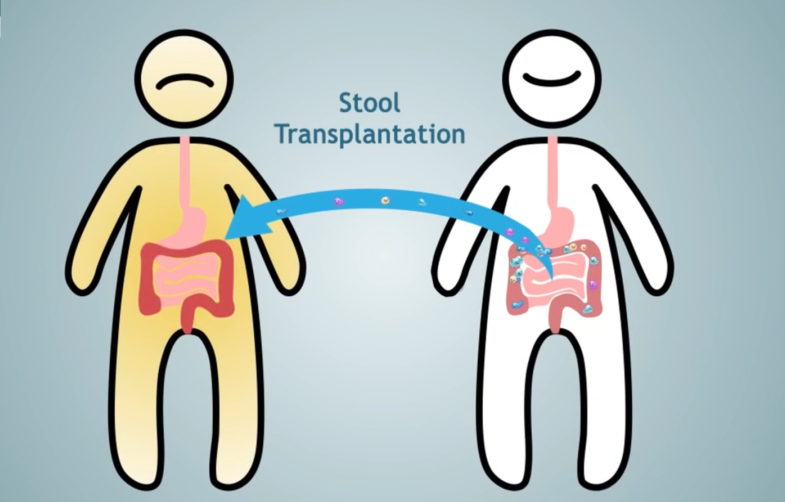
图8 肠道菌群移植FMT
截止2022年12月9日,在ClinicalTrial.gov上关于AS与FMT的临床研究已有两项,这意味着国际上已有关注使用FMT与AS的临床应用,FMT可能成为治疗AS的“新武器”。
图9
参考文献
[1] Yang L, Wang L, Wang X, Xian CJ, Lu H. A Possible Role of Intestinal Microbiota in the Pathogenesis of Ankylosing Spondylitis. Int J Mol Sci. 2016;17(12):2126. Published 2016 Dec 17. doi:10.3390/ijms17122126.
[2] Costello ME, Ciccia F, Willner D, et al. Brief Report: Intestinal Dysbiosis in Ankylosing Spondylitis. Arthritis Rheumatol. 2015;67(3):686-691. doi:10.1002/art.38967.
[3] Ebringer RW, Cawdell DR, Cowling P, Ebringer A. Sequential studies in ankylosing spondylitis. Association of Klebsiella pneumoniae with active disease. Ann Rheum Dis. 1978;37(2):146-151. doi:10.1136/ard.37.2.146
[4] Simone D, Al Mossawi MH, Bowness P. Progress in our understanding of the pathogenesis of ankylosing spondylitis. Rheumatology (Oxford). 2018;57(suppl_6):vi4-vi9. doi:10.1093/rheumatology/key001.
[5] Song ZY, Yuan D, Zhang SX. Role of the microbiome and its metabolites in ankylosing spondylitis. Front Immunol. 2022;13:1010572. Published 2022 Oct 13. doi:10.3389/fimmu.2022.1010572.
|